2022年6月17日,新葡的京集团8814校友刘聪团队(中科院上海有机化学研究所生物与化学交叉中心)与武汉大学梁毅团队在Nature Communications上在线发表了题为Cryo-EM structure of an amyloid fibril formed by full-length human SOD1 reveals its conformational conversion的长文(Article)。该研究全球首先解析铜锌超氧化物歧化酶(SOD1)纤维的高分辨率冷冻电镜结构,揭示了渐冻人症(ALS)致病蛋白质SOD1构象转化分子机制,为发展新的基于SOD1纤维结构的ALS治疗药物奠定了基础。

为了阐释SOD1由生理型向病理型转变的结构基础,研究者们制备了高度均一的全长人SOD1淀粉样纤维,发现这些纤维具有显著的细胞毒性,能够诱导细胞内的线粒体功能紊乱,并运用冷冻电镜结合三维重构技术在原子水平上解析了全长SOD1纤维的高分辨率结构(2.95 Å),发现SOD1纤维由单股原纤维以左手螺旋的方式缠绕而成,纤维宽度为12.3 nm,纤维核心直径是11 nm,半个螺旋周期为73.1 nm。纤维核心的疏水氨基酸侧链向内折叠形成5个疏水空腔,起到了稳定淀粉样纤维结构的作用。
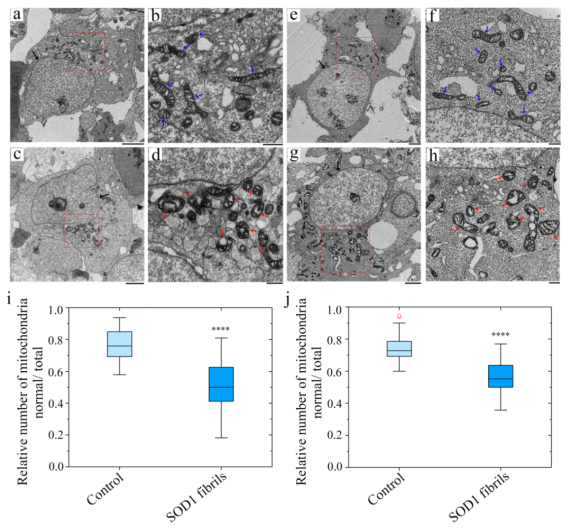
全长人SOD1纤维能够诱导细胞内的线粒体功能紊乱
为了进一步揭示SOD1淀粉样纤维的原子结构模型,研究组发现SOD1纤维核心由其N端的3-55区域和C端的86-153区域组成,而且这两个区域主要通过Lys36和Asp109之间、His43和Asp101之间以及His46和Glu100之间形成的3对盐桥紧密结合在一起。
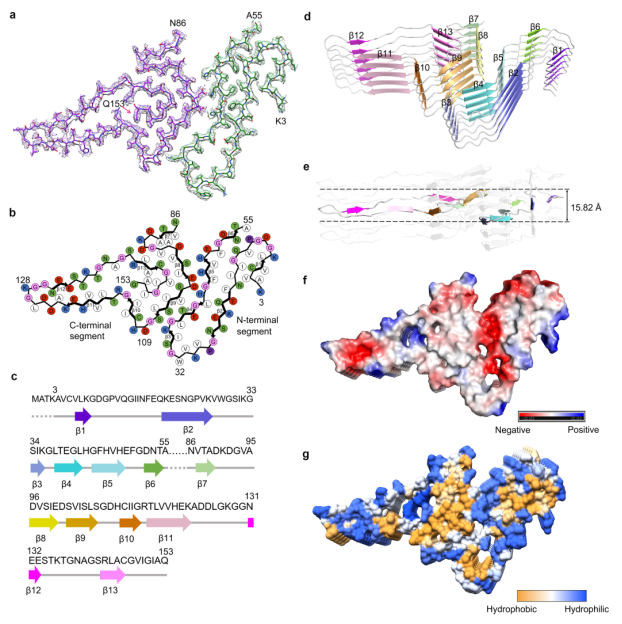
全长人SOD1纤维的原子结构模型
对于这样新奇的结构,研究团队对于其病理学意义进行了探索,发现在SOD1纤维结构中形成盐桥的五个关键氨基酸残基His43、His46、Glu100、Asp101和Asp109都是与ALS相关联的病理突变位点。
通过比较脱辅基SOD1二聚体结构,研究团队提出,在SOD1错误折叠过程中,脱辅基SOD1亚基的一个α-螺旋和由8个β-折叠组成的β-桶状结构转变成SOD1纤维的13个β-折叠结构。
该研究首次在原子水平上揭示了SOD1由生理型向病理型结构转变的机制,启示不同的病理突变体在调节SOD1构象转化中可能发挥着不同的作用,并使得发展新的基于SOD1纤维结构的ALS治疗药物成为可能,为SOD1聚集体结构与致病功能的深入研究奠定了分子基础,具有重要的科学意义。
中国科学院上海有机所交叉中心刘聪研究员和武汉大学新葡的京集团8814梁毅教授为该论文的共同通讯作者;武汉大学新葡的京集团8814博士后王利强、中国科学院上海有机所交叉中心博士生马烨阳和武汉大学新葡的京集团8814博士生袁菡烨为共同第一作者;华中农业大学生命科学技术学院殷平教授、中国科学院上海有机所交叉中心博士生赵焜和武汉大学土木建筑工程学院王正直副教授等参与了该论文的研究工作。
原文链接:
https://www.nature.com/articles/s41467-022-31240-4
消息来源:BioArt微信公众号
刘聪研究员简介

刘聪研究员,1998-2002年就读于新葡的京集团8814获得学士学位,2002-2008年就读于北京大学获得博士学位,之后在美国UCLA&HHMI从事博士后研究。现任中国科学院上海有机化学研究所生物与化学交叉研究中心研究员,博士生导师。刘博士近五年主持和参与多个国家及地方基金项目。包括:科技部重点研发计划、蛋白质重大专项、自然基金委重大仪器专项及面上项目、自然科学基金委重大计划、上海科委重大专项, 以及科技部青年863计划。并担任英国MRC,瑞士NSF,欧洲ERC等知名基金会的国际评审。Nature Chemistry、Cell Research、Molecular Cell、NC、eLife 等期刊的特约审稿人。