2022年5月30日,新葡的京集团8814校友刘聪(中科院上海有机化学研究所生物与化学交叉中心)、李丹(上海交通大学Bio-X研究院)近期特受邀在Nature Reviews Neuroscience杂志上发表了题为 Conformational strains of pathogenic amyloid proteins in neurodegenerative diseases 的长篇综述性文章。该文章全面、系统地总结了近几年来对于蛋白致病淀粉样聚集多态性的结构基础及分子机制的研究,探讨了聚集体构象多态性产生的结构基础,以及在不同类型的神经退行性疾病中的病理学意义。特别需要指出的是,作者在综述中首次提出蛋白纤维聚集体“构像原型(prototype)”和“病理功能画像(pathological profile)”这两个新的概念,阐释在不同的病理环境下,蛋白纤维聚集体结构的演化关系,并提出应从多个不同病理毒性特征维度来定义与刻画具有不同结构特征的蛋白病理聚集体在相应疾病中所呈现的综合病理毒性。这两个新的概念为理解具有高度复杂有序结构的蛋白病理聚集体在神经退行性疾病中的病理作用具有指导意义。

作者在综述中首先提出蛋白病理纤维聚集体的两个关键结构特征:同构性(isomorphism)和多态性(polymorphism)。对纤维同构性的了解有助于寻找神经退行性疾病发病机制的共性,开发广谱的药物。而纤维聚集结构的多态性则对于理解高度异质性的神经退行性疾病的发病机制至关重要。蛋白聚集结构多态性,是指同一种蛋白具有在不同病理条件下形成不同聚集结构与病理毒性的淀粉样纤维聚集体(即strains)的性质。针对神经退行性疾病患者脑组织来源及体外重组的病理纤维的大量研究结果显示,不同的蛋白纤维strains能够影响不同的细胞类型并在不同的脑区进行传播,对应临床表型的异质性。揭示不同strains的结构与相应疾病的对应关系将极大的推动神经退行性疾病亚型的精准分类和分子诊疗的发展。
作者进一步探讨了蛋白纤维聚集体的结构多态性的产生机制。天然的蛋白折叠通常形成三维的立体构象,然而在形成淀粉样纤维时,每个蛋白质单体通常形成富含β折叠且在同一平面展开的二维构象。与此同时,蛋白单体分子层之间通过β折叠之间的分子间氢键网络沿纤维轴向重复堆叠形成超分子复合体。与蛋白天然构象的三维折叠相比,纤维聚集体的二维折叠缺少更严格的分子内限制,导致同一蛋白单体能够形成多个能量相似的拓扑结构(图1),从而组装形成具有多种不同构象的蛋白纤维聚集体。不同纤维结构之间的差异主要包括蛋白单体内β折叠的排列不同,以及原纤维间的相互作用界面不同(图1)。
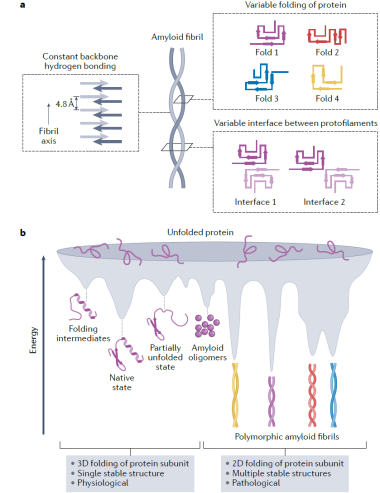
图1. 病理纤维聚集体的构象多态性的产生机制
接下来,作者详细阐释了纤维聚集构象多态性的动态调控机制。蛋白质序列的改变(如错义突变、截短等)以及共价或非共价化学修饰(如翻译后修饰、辅因子等),会引起分子内相互作用的重排或者建立新的分子互作模式,从而决定特定病理情况下的纤维聚集组装结构。通过进一步分析已报道的帕金森病关键病理蛋白α-syn的多种纤维聚集体结构,作者提出纤维聚集体“构像原型(prototype)”的概念,阐释对于特定的病理蛋白,众多的纤维聚集构象可能衍生于有限的几个构象原型,在不同的病理环境下,这些构象原型通过不同调控因子的作用,演化形成具有不同结构的病理聚集体。
作者进一步指出,对比现有的大量病理纤维聚集体组装及调控机制的研究,目前对于不同结构纤维在不同疾病中的致病机制研究还处在非常初期的阶段,人们尚无法从现有的结构信息解读其病理特征。目前已知,病理纤维聚集可以通过多种不同的途径发挥其病理毒性,驱动疾病的发展,包括:阻遏蛋白质降解、打破蛋白稳态、诱导线粒体等重要的细胞器功能失调、破坏细胞膜,以及病理纤维聚集的自我复制与细胞间传播。作者认为不同的strains之所以对应不同的病理毒性,是由于构象的变化赋予纤维不同的特性(如:形成以及复制纤维的能力、纤维的稳定性、对细胞降解的敏感性、被细胞摄取的效率等),从而在多个不同角度同时作用来影响上述不同途径的病理毒性。据此,作者提出pathological profile的概念(图2),把理解蛋白病理聚集体的病理毒性,放在一个复杂多因素共同决定的模型中,系统性地研究不同构象strains的病理毒性,及其与疾病亚型的因果关联。
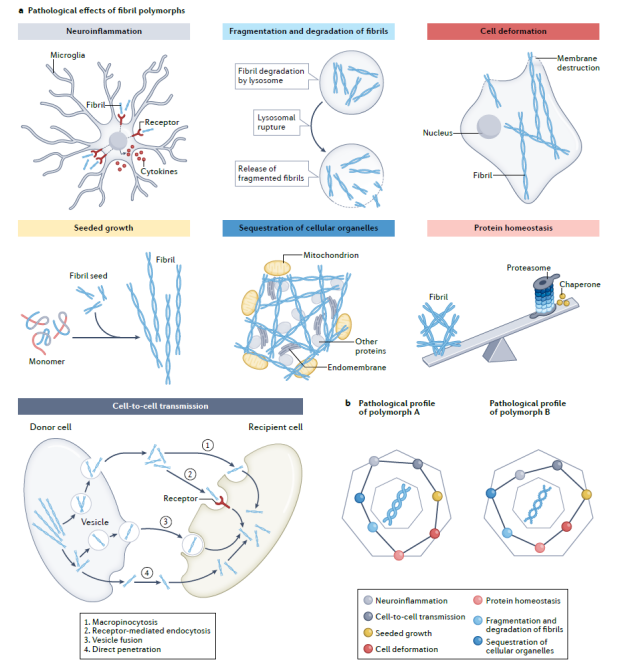
图2. 具有不同结构的病理纤维聚集体的pathological profile
最后,作者提出在疾病发展过程中,同一蛋白形成的病理聚集体结构与毒性存在动态变化的特征,与病程的发展密切相关。随着病理纤维聚集体在不同细胞和脑区间传播,细胞环境的变化能够通过翻译后修饰、辅因子等作用,在病理纤维的自我复制过程中发生改变,重塑其结构构象,进而改变病理毒性。未来对于病理纤维聚集体的结构及毒性随病程变化的深入研究将有助于疾病的精准分子分型、临床诊断分期,以及针对疾病不同发展阶段的特定靶向疗法的开发。在文末,作者特别展望了本领域几个有潜力的未来研究方向,包括:(1)推进基于病理纤维strains的神经退行性疾病的精准分型及分期;(2)靶向特定病理纤维strains的分子诊断示踪剂和药物开发;(3)发展体外重构特定结构纤维strains的新方法,以及表征不同strains的pathological profile的化学生物学新工具;(4)发展基于冷冻电镜断层扫描技术的细胞原位病理纤维聚集体结构表征技术。
文章链接:
https://www.nature.com/articles/s41583-022-00603-7
消息来源:BioArt微信公众号
刘聪研究员简介

刘聪研究员,1998-2002年就读于新葡的京集团8814获得学士学位,2002-2008年就读于北京大学获得博士学位,之后在美国UCLA&HHMI从事博士后研究。现任中国科学院上海有机化学研究所生物与化学交叉研究中心研究员,博士生导师。刘博士近五年主持和参与多个国家及地方基金项目。包括:科技部重点研发计划、蛋白质重大专项、自然基金委重大仪器专项及面上项目、自然科学基金委重大计划、上海科委重大专项, 以及科技部青年863计划。并担任英国MRC,瑞士NSF,欧洲ERC等知名基金会的国际评审。Nature Chemistry、Cell Research、Molecular Cell、NC、eLife 等期刊的特约审稿人。
李丹简介

李丹,1998-2002年就读于新葡的京集团8814获得学士学位,2002-2008年就读于北京大学新葡的京集团8814取得博士学位,2008-2014年在美国加州大学洛杉矶分校(UCLA) 从事博士后研究。现任上海交通大学Bio-X研究院特别研究员/长聘教轨副教授。近三年,共发表SCI论文30余篇。其中,以(共)通讯作者发表SCI论文近20篇,总影响因子超过200,包括:Cell (invited preview),Nature子刊 (7篇,含1篇invited perspective)、PNAS (2篇),Cell Research (2篇),Trends in Cell Biology (invited review), eLife 等。受邀为Cell,Nat. Chem. Biol. ,Trends in Cell Biol. 等国际一流期刊撰写专家评论、综述、展望科研发展方向等。主持或参与国家自然科学基金面上(2项)、重大培育、上海市科委、教委等项目。获得上海高校特聘教授(东方学者) (2019) 、上海市浦江人才项目 (2018) 支持。