新葡的京集团8814分子酶学工程教育部重点实验室高仁钧教授团队与丹麦奥胡斯大学郭诤教授团队合作,提出了新型无溶剂液体蛋白(酶)的设计策略。将枯草杆菌脂肪酶LipA先离子化修饰,再与离子聚合物交联,成功合成液体酶,使常温酶具备了超嗜热酶的催化特性,该成果在生物催化中颇有应用潜力。相关研究内容已于近日以题为"Superanionic Solvent-Free Liquid Enzymes Exhibit Enhanced Structures and Activities”发表于Advanced. Science. (2022, 2202359). https://doi.org/10.1002/advs.202202359

高仁钧教授课题组长期从事嗜热酶的研究,但由于嗜热酶来源有限,因而其选择和应用常常受到限制。无溶剂液体蛋白质(也称为生物流体或蛋白质液体)是一类新型混合纳米生物材料,由于其具有一些引人注目的性质,包括近天然结构、超热稳定性等,因而在生物催化领域颇具有潜力。通过离子修饰剂使电荷充满酶分子的表面,再通过静电作用交联一定数量的离子聚合物,使聚合物稳定包裹在酶表面,形成具有一定厚度的“壳”结构。而正是这一层“壳”在去除溶剂后增大蛋白质粒子的体积了蛋白质分子间距,有效阻止了酶分子之间的相互作用,同时维持了酶的构象稳定,从而使普通酶分子能在常压下,通过加热和退火并在高温下形成离子型无溶剂液体酶(图1)。本研究中通过纳米材料的修饰,将常温酶改造成了超嗜热酶,使各种不同来源的酶都有了成为嗜热酶的潜力。
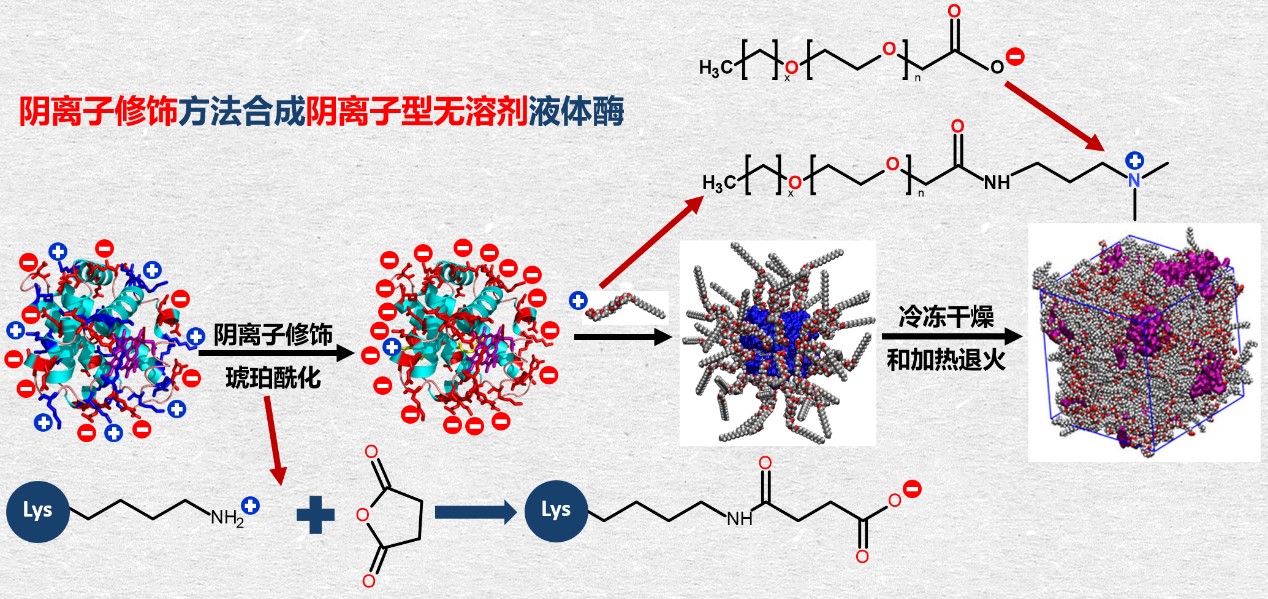
图1,液体酶合成途径。
本研究中,作者选取枯草杆菌脂肪酶LipA 8M突变体为研究对象,使用琥珀酸酐对蛋白质分子表面氨基(Lys残基侧链和N端α-氨基)进行完全修饰,使蛋白表面阴离子最大化,再与阳离子聚合物(cS)进行交联,形成阴离子型无溶剂液体蛋白[a8M][cS]。作为对比,以N,N’-二甲基-1,3-丙二胺(DMPA)修饰蛋白表面阴离子,再与阴离子聚合物(S)交联,形成阳离子型无溶剂液体蛋白[c8M][S] (图2)。
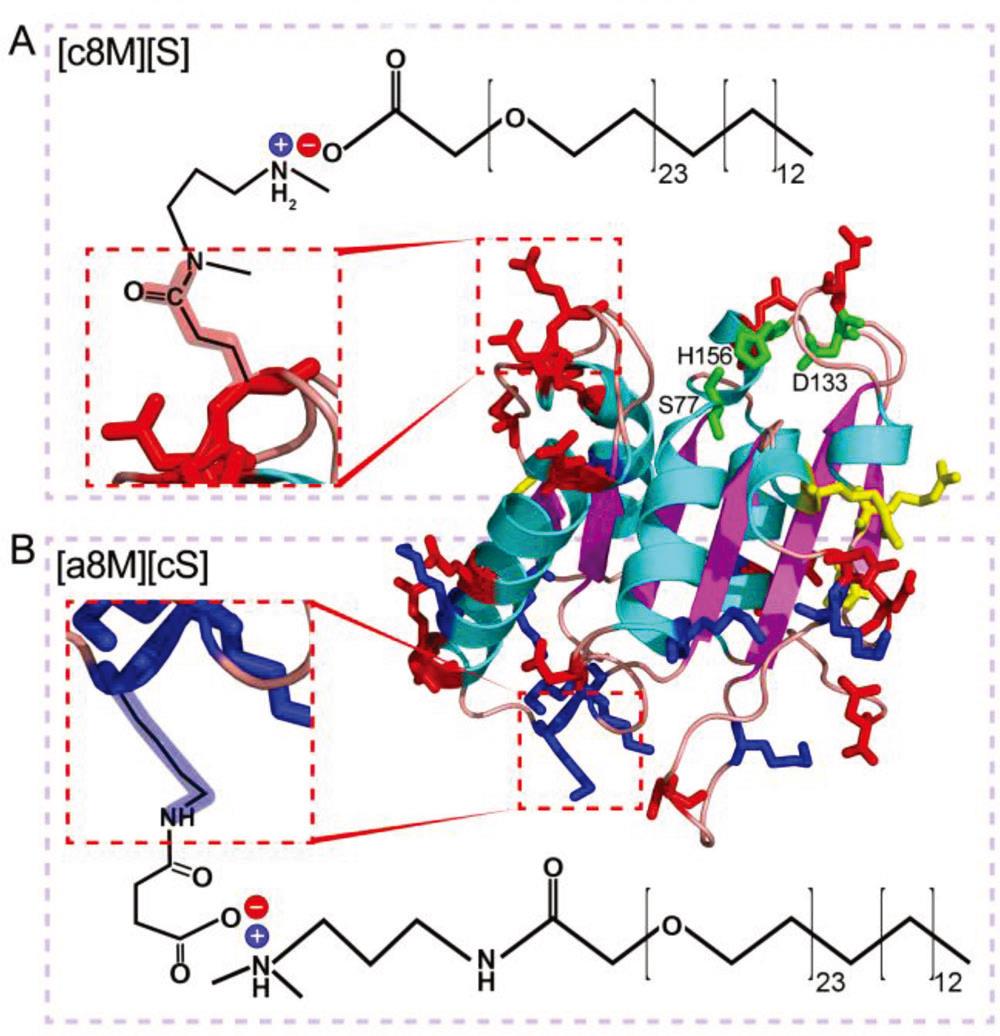
图2,阴离子和阳离子液体酶差别
实验中使用SRCD、SAXS、DSC、ATR-FTIR、UV-vis等多种生物物理和化学表征手段对液体蛋白合成的各个阶段进行了表征与鉴定。结果表明,在脂肪酶制备液体蛋白的研究中,通过阴离子修饰合成的液体脂肪酶[a8M][cS]无论在结构完整性和活力上都高于阳离子型液体脂肪酶[c8M][S]。本研究中同时以肌红蛋白(Mb)作为对照蛋白进行了相应的液体蛋白的合成。在肌红蛋白的液体蛋白合成研究中,阴离子修饰导致了Mb的完全变性去折叠,同时蛋白的旋光性也发生了改变,但是与cS聚合物的交联后蛋白实现再折叠。阴离子型液体蛋白[aMb][cS]的α-螺旋水平高于[cMb][S],稳定性更强。此外,阴离子液体酶的活性也远高于阳离子液体酶,并且在120℃下依然保持了10%以上的活性(图3),实现了常温酶向超嗜热酶的转变。阴离子型无溶剂液体蛋白优点更明显,适用性更强,为研究者在高温下催化反应提供了更多的选择。

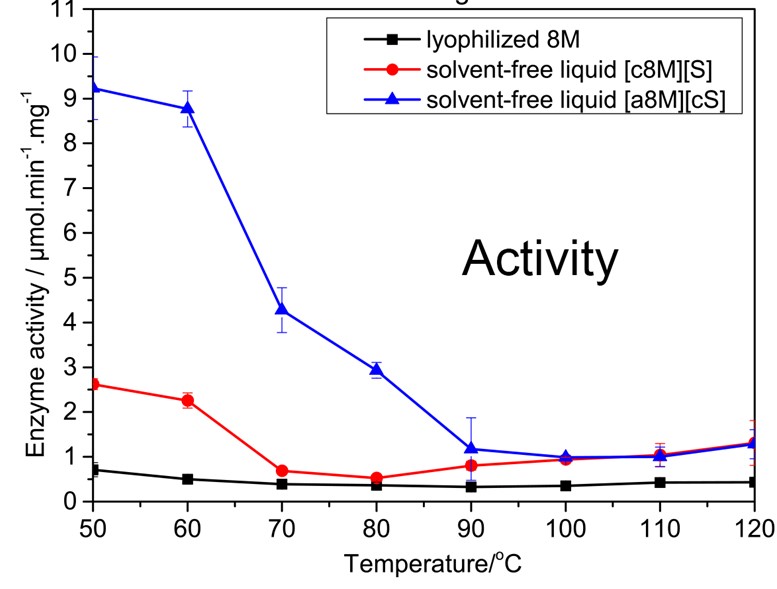
图3,不同液体酶的圆二色谱和酶活力比较
本研究工作得到了国家留学基金委、诺和诺德基金会和AUFF创新基金的资助。论文第一完成单位为新葡的京集团8814,第一作者为新葡的京集团8814已毕业博士生周烨。新葡的京集团8814分子酶学工程教育部重点实验室高仁钧教授与丹麦奥胡斯大学技术科学学院郭诤教授为论文的共同通讯作者。
论文全文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202202359