近期,新葡的京集团8814于湘晖教授、于彬教授团队在肿瘤免疫治疗领域连续取得重要进展,两项相关研究成果连续被国际生物医学重要学术期刊《Cancer Letters》和《Acta Biomaterialia》接收发表。

于湘晖教授、于彬教授团队利用前期设计的靶向型溶瘤腺病毒(CRAd5-TRAIL)与表达CD40L的基因治疗载体联用,通过对肿瘤微环境进行免疫调节,增强了抗肿瘤活性,为溶瘤腺病毒介导的实体瘤免疫治疗提供了新策略。研究成果被肿瘤学专业期刊《Cancer Letters》接收,并将于2022年6月1日发表(Oncolytic adenovirus-mediated intratumoral expression of TRAIL and CD40L enhances immunotherapy by modulating the tumor microenvironment in immunocompetent mouse models, 2022,535: 215661, https://doi.org/10.1016/ j.canlet.2022.215661)
肿瘤微环境的免疫状态是决定抗肿瘤免疫治疗效果的关键因素。课题组前期研究证明,表达肿瘤坏死因子相关凋亡诱导配体(TRAIL)的溶瘤腺病毒(CRAd5-TRAIL)在多种人肿瘤细胞异种移植模型中具有显著的抗肿瘤活性。然而,其在免疫全能小鼠模型中的肿瘤抑制能力及免疫调节机制尚不清楚。因此,研究团队首先在几种小鼠肿瘤模型中探索了CRAd5-TRAIL的抗肿瘤活性,发现其能够增加或激活肿瘤浸润T细胞。为进一步提高抗肿瘤效果,首次将表达小鼠CD40配体(CD40L)的重组腺病毒载体作为免疫激活剂与CRAd5-TRAIL联合用于肿瘤免疫治疗。体内外的研究表明,联合治疗有效地激活了肿瘤微环境中的树突状细胞(DCs)、B细胞和肿瘤浸润T细胞,并通过上调TRAIL受体的表达促进肿瘤细胞凋亡,从而进一步增强了溶瘤腺病毒的抗肿瘤活性。该研究为团队正在开展的溶瘤腺病毒临床前研究以及后续临床研究奠定了基础。新葡的京集团8814为该论文唯一完成单位,第一作者为新葡的京集团8814博士生刘文茉,新葡的京集团8814于湘晖教授和于彬教授为该论文的共同通讯作者。
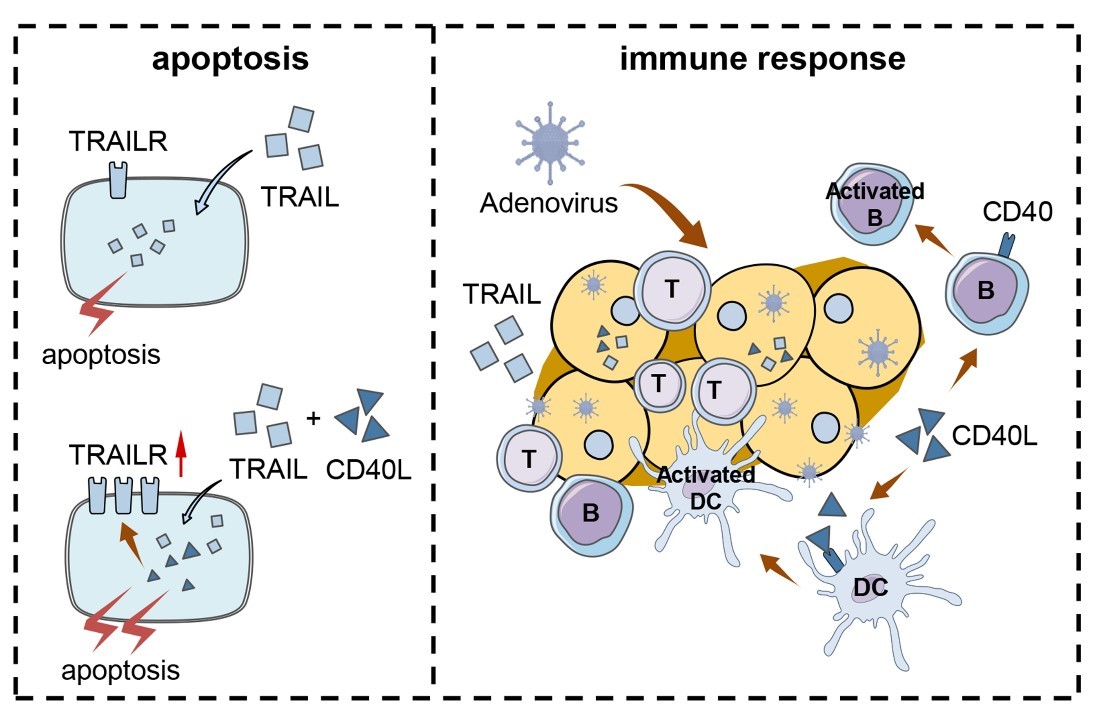
图1. CRAd5-TRAIL和Ad5-CD40L联合治疗作用机制示意图
于湘晖教授、于彬教授团队的另一项关于肿瘤靶向免疫治疗的研究于2022年4月15日在生物医学期刊《Acta Biomaterialia》上发表(TRAIL-modified, doxorubicin-embedded periodic mesoporous organosilica nanoparticles for targeted drug delivery and efficient antitumor immunotherapy,2022,143:392-405, https://doi.org/10.1016/j.actbio.2022.03.001.)。团队与新葡的京集团8814无机合成与制备化学国家重点实验室乔振安教授合作,利用TRAIL修饰的周期性介孔二氧化硅(PMO)作为药物载体携载化疗药物,在小鼠模型上通过静脉给药实现了肿瘤的靶向和协同杀伤作用,并引发了有效的抗肿瘤免疫。研究首次证实TRAIL修饰的PMO能够在体内外诱导肿瘤细胞产生ICD,进而通过激活DCs,提升肿瘤杀伤T细胞的浸润和活性,产生更好的抗肿瘤效果。该研究为设计具有抗肿瘤免疫激活功能的靶向纳米药物提供了新的思路。
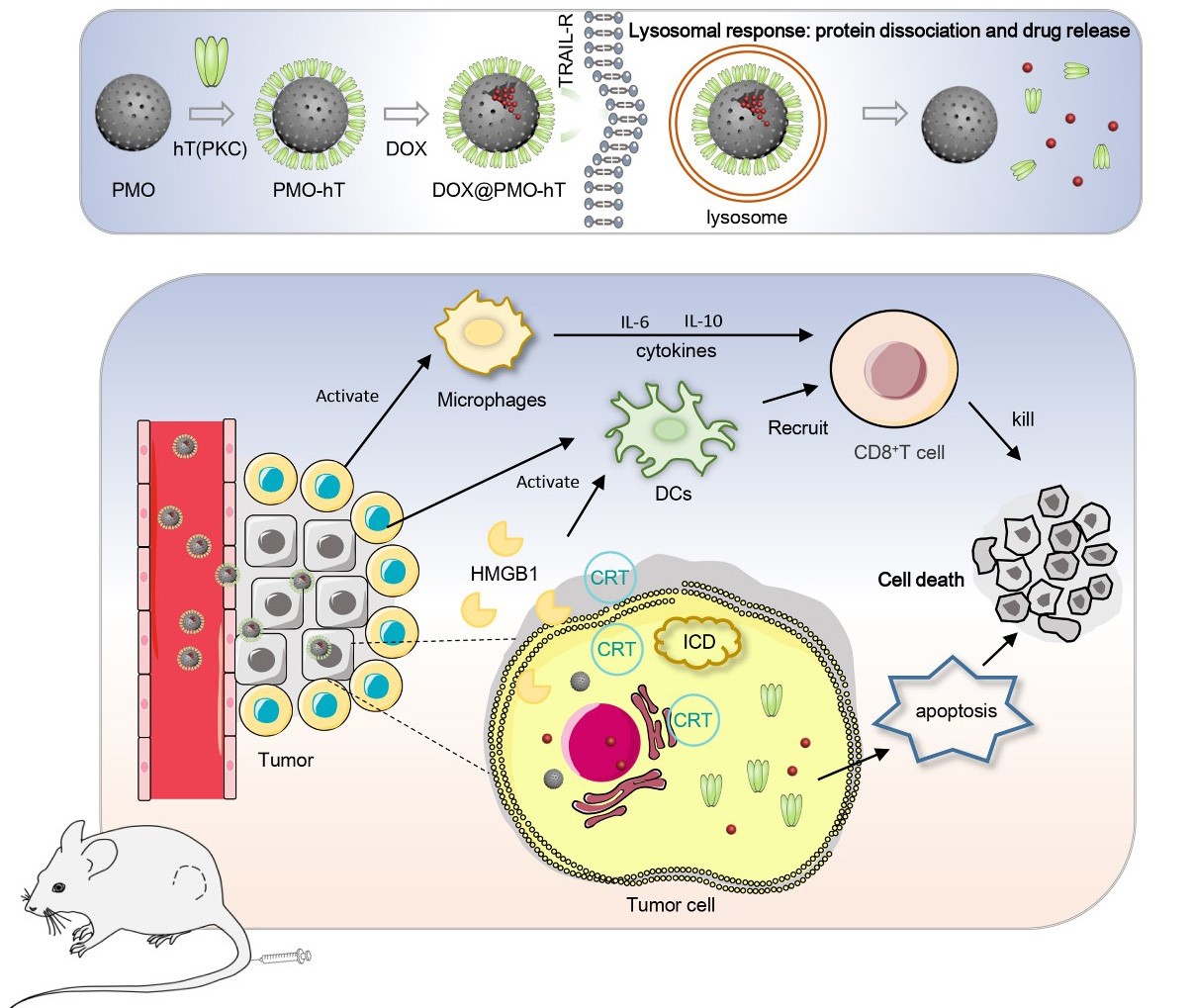
图2. DOX@PMO-hT(PKC)设计及抗肿瘤机制示意图
论文第一完成单位为新葡的京集团8814,第一作者为新葡的京集团8814博士生冯馨瑶,新葡的京集团8814于湘晖教授和于彬教授为该论文的共同通讯作者。
上述两项研究得到了国家自然科学基金、吉林省科技发展计划、新葡的京集团8814高层次科技创新团队和中央高校基本科研专项基金等项目资助。同时对合作者乔振安教授为第二项研究提供的大力支持表示由衷的感谢!